近日,77779193永利集团、北大-清华生命联合中心王初课题组与永利集团药学院董甦伟课题组合作在JournaloftheAmerican Chemical Society杂志上发表了题为“Discovery of itaconate-mediated lysine acylation”的论文。在这项工作中,作者利用抗体“脱靶”富集结合开放式搜索策略在巨噬细胞中发现了一种由衣康酸介导的赖氨酸上的新型翻译后修饰——衣康酰化修饰,并对该修饰及其前体衣康酰辅酶A在免疫响应过程中的动态变化进行了表征。该修饰的发现为解释衣康酸发挥免疫调控功能的机制提供了新的线索。
衣康酸(itaconate)是一类近年来发现具有免疫调控活性的内源代谢物小分子,它被发现在病原菌刺激后的巨噬细胞中大量生成,并可通过结构中的亲电性α,β-不饱和羧酸结构对蛋白上的活性半胱氨酸残基进行迈克尔加成,这一翻译后修饰被称为“衣康酸修饰(itaconation)”。王初课题组此前先后通过竞争性ABPP策略以及生物正交的化学探针实现了巨噬细胞及病原菌中衣康酸修饰位点的大规模研究(Nat chem biol 2019,JAmChemSoc 2020, ChemSci 2021)。近年来有研究暗示了衣康酸可能还存在着其它的调控途径,但截至目前,尚无其它由衣康酸介导的修饰形式被报道。
作者在研究巨噬细胞经衣康酸处理后琥珀酰化修饰的水平变化时,意外地通过开放式搜索在质谱结果中发现了一个此前未知的翻译后修饰,该修饰的数目随着衣康酸的处理有着明显提升,其对应的分子式C5H4O3正好吻合衣康酸通过结构中的羧基与赖氨酸所形成的衣康酰化修饰。由于赖氨酸上的酰基化修饰通常以对应的酰基辅酶A作为前体,作者随后在巨噬细胞中检测到了内源衣康酰辅酶A的存在,其含量随着衣康酸的处理有显著上升,并确定了辅酶A连接在远离双键的羧基上。
作者进一步发现使用细菌表面抗原模拟物刺激巨噬细胞后,衣康酰辅酶A及衣康酰化修饰的水平均有显著上升。在三次生物学重复中作者共鉴定到了87个高置信度的衣康酰化修饰位点,其中包括一些存在多个修饰位点的蛋白,例如具有7个修饰位点的组蛋白H2B1B和多个糖酵解关键酶,暗示着衣康酰化修饰可能具有表观遗传调控和对糖酵解通路的调控作用。最后作者利用合成的重标修饰肽对修饰结构进行了确证。
衣康酰化修饰的发现为解释衣康酸参与天然免疫调控的机制提供了一条全新的路径。此外,本工作采用的抗体“脱靶”富集+开放式搜索策略也为在复杂蛋白质组中发现其它新型翻译后修饰提供了一种新思路。
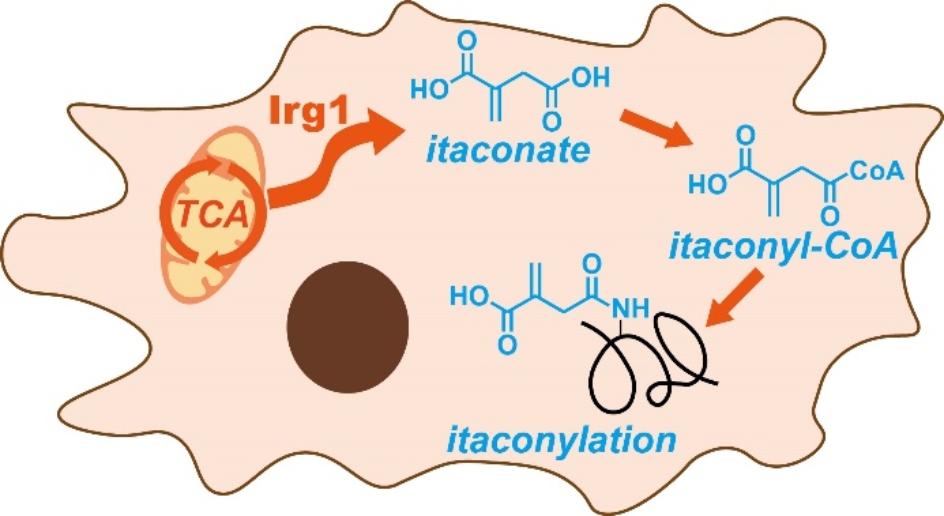
图1. 内源代谢物衣康酸通过生成衣康酰辅酶A在蛋白质赖氨酸侧链产生酰基化修饰
王初教授、董甦伟教授为该论文的共同通讯作者,77779193永利集团博士生刘东阳、博士后肖伟弟、永利集团药学院硕士生李昊亭为本文的共同第一作者,张艳玲,袁守丽、李成蹊等为该工作做出了重要贡献。该工作得到了科技部国家重点研发计划、国家自然科学基金委重大研究计划、北京分子科学国家研究中心等项目的资助。
论文链接:https://pubs.acs.org/doi/10.1021/jacs.3c02332