77779193永利集团张俊龙课题组在AngewandteChemie International Edition在线发表题为“Gallium Triggers Ferroptosis through a Synergistic Mechanism”的研究论文,发现镓干扰细胞氧化还原稳态,诱导铁死亡的协同机制(Angew. Chem. Int. Ed., 2023,62,e202307838)。
在生命医药领域,镓是仅次于铂的金属,研究历史悠久,其化合物广泛应用于抗菌、抗炎、抗肿瘤以及骨代谢疾病的治疗。在抗癌机制方面,由于镓离子(Ga3+)和铁离子(Fe3+)在电荷和离子半径等性质上的高度相似性,被认为是氧化还原惰性的“铁替代”,在生物体内能够干扰Fe3+的代谢和稳态,并作为Fe3+的竞争性抑制剂,破坏含铁酶(如核酸还原酶)的活性,导致细胞死亡。长期以来,这种“铁替代”假说成为镓药物设计的生物化学基础,并促进了镓抗癌药物快速发展(Eur. J. Inorg. Chem., 2022, e202100953)。近年来,镓配合物诱导铁死亡案例先后被报道,然而深入研究镓和铁稳态及与其他细胞过程之间的关系,以及镓在铁死亡中扮演的角色仍需进一步的阐明。
张俊龙课题组与合作者此前报道了首例可靶向蛋白质二硫化物异构酶(PDI)的Ga(III)salen配合物(Ga-1)(Angew. Chem. Int. Ed.,2020,59,20147)引发内质网应激诱导细胞发生非经典凋亡的程序性死亡,实现肿瘤治疗。近期,他们发现Ga3+的强路易斯酸性,使Ga-1能通过配位作用与线粒体内膜上带负电荷的磷脂和羟基结合,改变膜内外的质子梯度,破坏膜结构与线粒体功能。进而,Ga-1诱导了应激蛋白卟啉氧化酶-1(HMOX-1)表达量的上升,导致线粒体铁过载,诱导细胞脂质过氧化。另一方面,该课题组发现Ga-1能通过抑制PDI破坏谷胱甘肽系统,诱导谷胱甘肽系统中负责胱氨酸摄取的SLC7A11和负责脂质过氧化物清除的GPX4的下调,破坏了细胞抗氧化能力。这种双管齐下的协同诱导或加剧细胞铁死亡机制使抗肿瘤效果更加显著。不同于传统的“铁替代”假说,该研究为阐明Ga-1的作用方式提供了重要线索,为发展新型镓抗癌药物的分子设计提供了新思路。
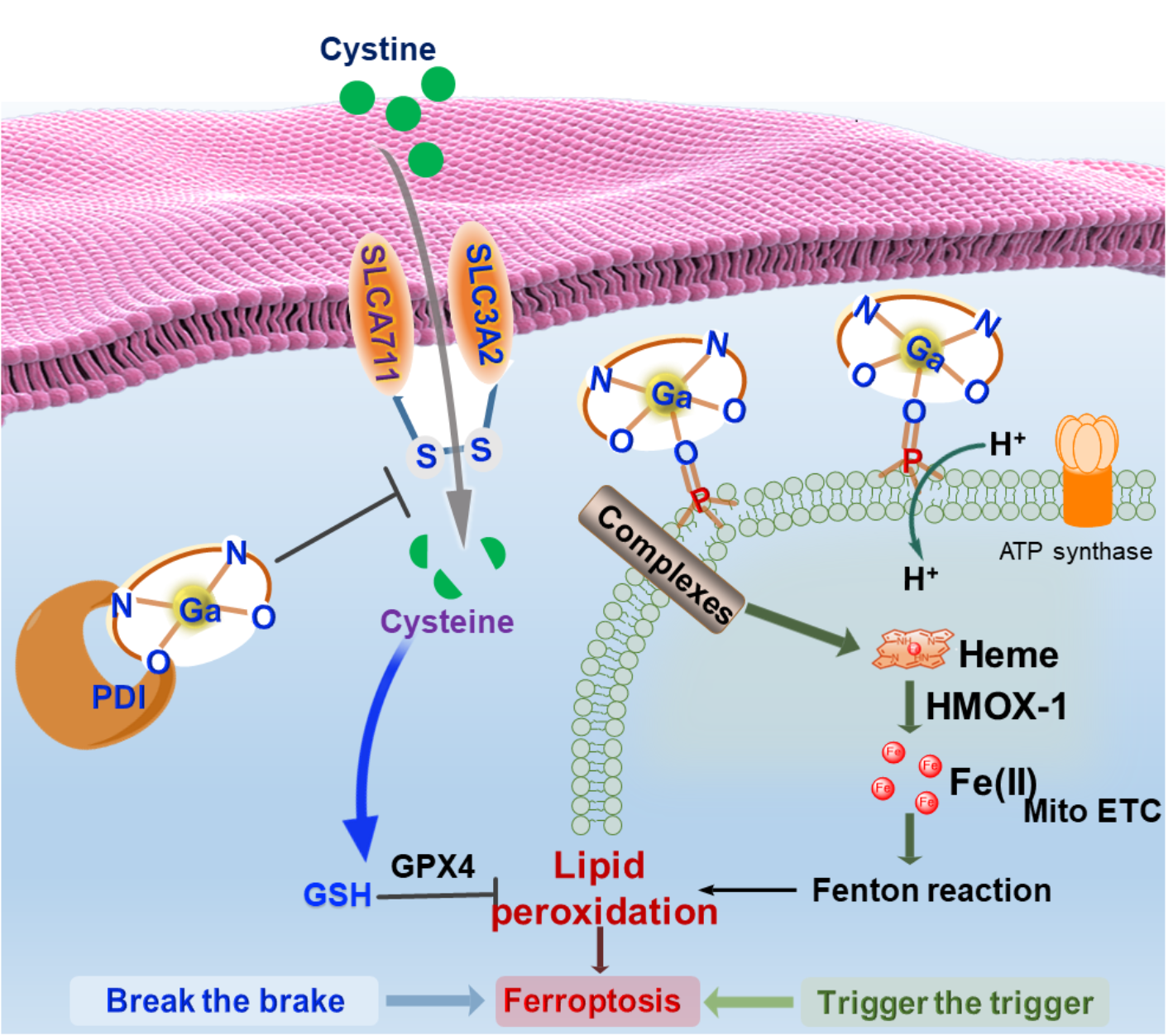
镓诱导铁死亡的协同机制
张俊龙教授为该论文的通讯作者,77779193永利集团博士研究生彭信心为第一作者。该工作得到了国家自然科学基金委、北京分子科学国家研究中心、广东省化学与精细化工实验室等机构的资助。
论文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202307838
图文:张俊龙课题组
排版:高杨
审核:牛林,彭海琳