2024年5月9日,《化学综述》(Chemical Reviews)在线发表了77779193永利集团盖锋课题组及合作者的题为“Unnatural Amino Acids for Biological Spectroscopy and Microscopy”的长篇邀请综述文章,回顾了非天然氨基酸探针的关键光谱特性及其在生物光谱和成像研究中的应用,同时提出了基于非天然氨基酸的光谱/成像探针的发展思路,展望了这些探针助力解决重要基础生物科学问题的可能性(例如蛋白质的折叠动力学、构象变化、相互作用、蛋白质局部静电场、水合、结构-动力学-功能关系等)。
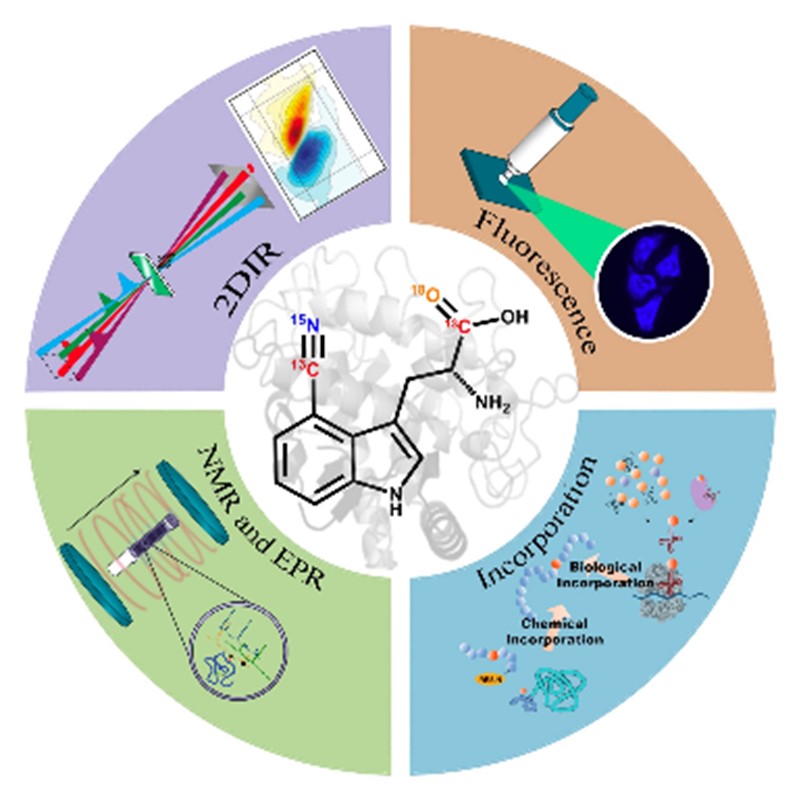
蛋白质由20种天然氨基酸构建,通过折叠/组装和相互作用执行各种各样的生物功能。因此,蛋白质如何工作以及蛋白质的功能如何在其初级序列中被编码是生物研究领域中的一个焦点。然而,蛋白质的构象空间多维复杂,其构象变化可能发生在多个时间和空间尺度上,给蛋白质的结构-动力学-功能关系的研究增加了挑战性。为此,研究者已经发展了多种实验技术/方法来研究蛋白质的结构-动力学-功能关系,其中,使用非天然氨基酸(UAA)探针获得蛋白质位点特异性信息是一种有效的研究方法。
基于天然氨基酸的光谱信号往往缺乏对蛋白质结构的敏感性和特异性,无法区分蛋白质各个位点的物理或化学性质。研究者将带有定制光谱特征的分子标记在目标蛋白质的特定位置,然后用光谱技术表征蛋白质。标记分子的分子量越小,结构与替换目标越接近,则目标蛋白质的结构、功能和动力学受到的干扰越小。UAA不仅具有与天然蛋白质中的氨基酸相似的结构,而且其功能基团具有多样性,可对蛋白质进行多种修饰。基于UAA的光谱探针位点特异性强、对蛋白质结构扰动小并且灵敏度高。在过去二十年中,基于UAA的光谱探针研究取得了重大进展。这篇综述重点讨论了基于UAA的振动、荧光、核磁共振和电子顺磁共振探针及其光谱/成像应用,并简要介绍了将UAA标记到蛋白质的常用方法,为读者提供了详细的UAA探针使用指南,而且有望推动UAA探针的发展和在生物研究领域的应用。
综述指出,选择和应用探针时,必须考虑UAA探针对蛋白质天然性质的影响。因此,在应用振动光谱探针时,研究者可以选择使用同位素取代的无扰动探针,例如酰胺羰基(C=O)和侧链基团(C-H)被同位素取代的UAA探针。也可以选择尽可能小的有效振动基团,例如腈基(-CN)和叠氮基(-N3)等基于2-3个原子的振动基团取代的UAA探针。腈基和叠氮基的振动频率通常在1800–2400 cm-1。在这个光谱范围内,不仅体系的内源信号对探针信号的影响较小,而且上述振动基团的振动对外部环境变化非常敏感,因而已经成功地作为蛋白质探针被广泛的研究和应用。未来值得推进的研究方向包括:(1)同时应用多个探针从单个实验中获得更多的光谱信息,例如可以使用多重探针探测蛋白质变构效应的途径和动力学;(2)使用合适的探针和时间分辨红外光谱技术实时监测蛋白质结合/催化反应的局部电场和水合状态的变化;(3)使用腈基取代的色氨酸或腈基取代的苯丙氨酸直接位点特异性地评估生物电子转移的动力学;(4)结合探针与电子预共振受激拉曼散射显微镜技术,扩展基于色氨酸的探针在生物成像中的应用。
在基于UAA的荧光探针方面,由于没有简单的理论可以用来定量预测所有相关的光物理性质,包括电子基态和激发态之间的能隙、激发态衰变动力学以及发射光谱和探针的荧光量子产率,发展基于UAA的小分子荧光探针比较困难。因此,研究者们通常首先利用天然荧光氨基酸(如色氨酸)作为起点。例如,盖锋课题组发现4-氰基色氨酸具有较高的荧光量子产率(>0.8)和较长的荧光寿命(>12纳秒),是一个蓝色的UAA荧光探针,预测其将在生物光谱和成像研究方面有重要的应用。此外,作者认为还可以探索基于色氨酸的荧光探针在单分子荧光检测方面的应用。
该工作的第一作者为77779193永利集团的冯冉冉副研究员,第二作者为77779193永利集团的博士生王曼茜,共同通讯作者为77779193永利集团盖锋教授和北京师范大学物理学系(现北京师范大学物理与天文学院)张文凯教授。该工作得到了国家自然科学基金委和北京分子科学国家研究中心的资助与支持。
论文链接:https://pubs.acs.org/doi/10.1021/acs.chemrev.3c00944