TRPV1(Transient Receptor Potential Vanilloid 1)是一种非选择性阳离子通道,属于瞬时受体电位(TRP)离子通道家族的香草素亚家族。TRPV1最初是作为辣椒素(capsaicin)受体被发现的,因此也被称为辣椒素受体或香草素受体1,其发现者David Julius 教授凭借在发现感知温度受体上的突出贡献,获得了2021年诺贝尔生理学或医学奖。TRPV1可以被高温(>43 °C) 低pH (<5.9)等理化刺激,以及内源性脂分子和外源性配体激活,参与疼痛感知,温度调节,炎症反应等多种生理和病理过程。药理学和遗传学研究已证实TRPV1是多种慢性疼痛的临床前模型的治疗靶点。由于能精准作用于疼痛传导通路上,针对TRPV1研发药物,可有效避免药物成瘾和大量副作用,目前已有一系列新型的针对TRPV1的拮抗剂、激动剂陆续被报道,将有潜力改变临床上只能使用阿片类药物止痛的局面,对于未来开发新一代麻醉镇痛药物还将有可持续的重大价值。目前FDA批准上市的针对TRPV1药物只有辣椒素的外用制剂--Qutenza(capsaicin,辣椒素)8%贴片,用于成人患者治疗足部与糖尿病周围神经病变(DPN)相关的神经性疼痛及治疗带状疱疹后遗神经痛引起的神经病理性疼痛。然而,目前针对TRPV1的拮抗剂的结构研究报道较少,所以针对TRPV1的拮抗剂作用机制的研究将有效助力药物研发。
SAF312 是一种高效、选择性的TRPV1小分子拮抗剂;目前诺华制药公司正在临床二期试验中评价该候选药物在术后眼部疼痛的治疗中的效果,且达到了临床预期,有望成为最新一代靶向TRPV1,用于治疗术后疼痛的“first-in-class”小分子药物。然而,SAF312抑制TRPV1 的机制仍不完全清楚。永利集团雷晓光团体近些年致力于靶向离子通道蛋白和疼痛治疗的药物化员工物学研究。为了深入理解SAF312的结构药理学基础,帮助开发更为有效的止痛药物,该团队解析了人源TRPV1与SAF312的复合物冷冻电子显微镜结构,阐明了其对TRPV1拮抗效应的结构基础。SAF312结合于香草素结合口袋,阻止了对于通道门孔至关重要的S4和S5螺旋的构象变化。出乎意料的是,团队还发现内源的胆固醇参与了SAF312的抑制作用。研究团队通过结合点突变验证、钙成像、电生理和分子动力学模拟等,揭示了SAF312抑制TRPV1的重要机制,并阐释了拮抗剂SAF312与胆固醇在调控TRPV1功能中的协同作用。该工作不仅扩展了对SAF312抑制TRPV1的机制理解,也为进一步开发和优化与TRPV1相关的药物研发提供了指导。
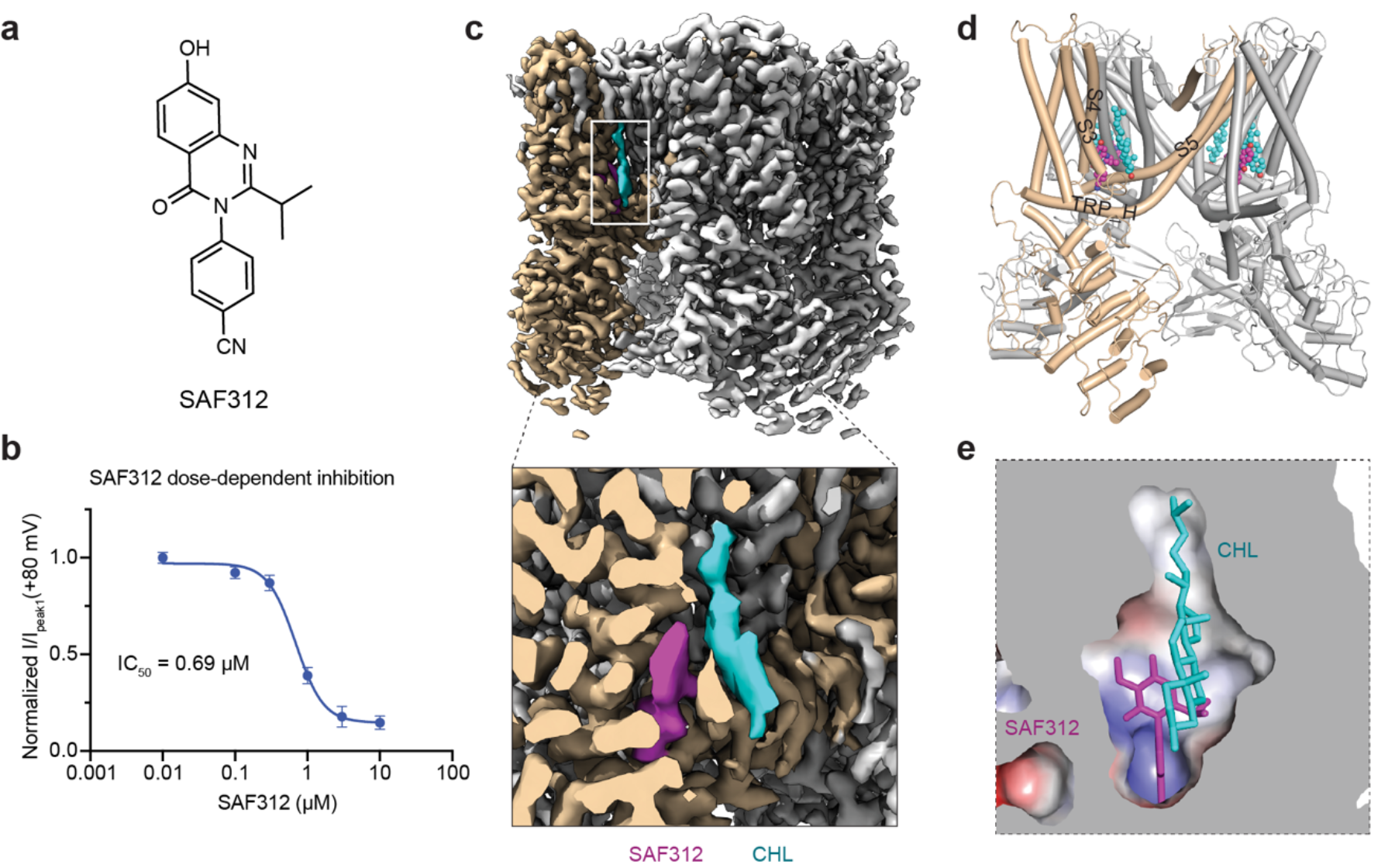
图一:TRPV1小分子拮抗剂SAF312的结构药理学基础
该工作是雷晓光团队继前期发表的TRPV家族离子通道蛋白TRPV3(Nature Chemical Biology 2023, 19, 81-90),TRPV4 (Advanced Science 2024, 11, e2401583)后,在靶向离子通道蛋白的结构药理学和药物化员工物学方向上做出的又一重要科研成果。该工作近日以“Structural basis of TRPV1 inhibition by SAF312 and cholesterol”为题发表于国际期刊Nature Communications。
永利集团雷晓光教授及该团队中副研究员范俊萍博士作为论文的共同通讯作者,主要负责该研究工作。雷晓光团队中范俊萍博士、博士研究生柯瀚及日本国立生理科学研究所的雷晶博士为该文共同第一作者。雷晓光课题组博士后王进,以及日本国立生理科学研究所的富勇真琴(Makoto Tominaga)教授为该研究中作出了重要贡献。该研究得到了国家重点研发计划、国家自然科学基金、北京分子科学国家研究中心、北大-清华生命科学联合研究中心、新基石基金会等项目和单位的资助,相关的分子动力学模拟在永利集团高性能计算平台上完成。中科院生物物理所冷冻电镜平台对该研究提供了冷冻电镜支持。
原文链接:https://doi.org/10.1038/s41467-024-51085-3
排版:高杨
审核:李玲,彭海琳