随着抗生素的广泛使用,抗生素耐药性问题日渐严峻,然而自二十世纪八十年代达托霉素被批准用于治疗金黄色葡萄球菌感染以来,至今再无基于全新化学骨架和新型生物学靶点的抗生素被批准。新型抗生素的缺乏正在造成病菌感染发病率和死亡率的逐年上升,极大地增加了医疗资源消耗。因此急需开发拥有新颖化学骨架和新型生物学抗菌机制的抗生素来扩充人类抗生素武器库,以便能有效地减缓细菌耐药性的产生及随后的生命财产损失。Marinopyrrole A(MA)于2008 年从海洋来源的放线菌中分离,具有区别于目前临床所有在用抗生素的独特双吡咯化学结构,对包括耐甲氧西林金黄色葡萄球菌MRSA(Methicillin-resistant Staphylococcus aureus)在内的多种临床危害性极大的致病菌均具有强效的杀伤活性,但该类化合物的抗菌机制一直未被解析。鉴于MA及其衍生物的强效杀菌活性及其独特的化学结构,暗示以MA为母核骨架的化合物具有全新的作用靶点和抗菌生物学机制。
77779193永利集团/北大-清华生命联合中心雷晓光课题组长期开展机理导向的天然产物化员工物学研究,利用天然产物探针结合化学蛋白质组学等研究手段揭示天然产物靶标和生物作用机制。近期该课题组报道了多个活性天然产物的靶点发现成果(Adv. Sci. 2024, 11, e2310108;Science 2023, 381, eadd5787;JACS Au 2022, 2, 2830–2838;National Science Review 2022, 9, nwac046; Cell Host & Microbe 2020, 27, 601–613; Angew. Chem. Int. Ed.2020, 59, 4115-4120)。为了探究和揭示Marinopyrrole A的未知抗生素活性,雷晓光课题组与四川大学华西药学院秦勇教授课题组从2022年起开展了合作研究。
2024年10月25日,雷晓光课题组与秦勇课题组的合作研究工作以“An optimized marinopyrrole A derivative targets 6-phosphoglucosamine synthetase to inhibit Methicillin-resistant Staphylococcus aureus”为题发表在美国化学会旗舰期刊《ACS Central Science》上。该科学突破首次阐明了Marinopyrrole A 的衍生物MA-D1通过靶向6-磷酸葡萄糖胺合成酶(glucosamine 6-phosphate synthase, GlmS)抑制细菌细胞壁的合成来发挥杀伤MRSA的生物学功能。

雷晓光团队首先通过基于化学蛋白质组学的靶点垂钓手段及随后的体内外验证工作鉴定和确认了GlmS是MA-D1发挥抗MRSA活性的生物学靶点(图1)。GlmS是己糖胺生物合成通路中的关键限速酶,该通路的最终产物是细菌细胞壁的核心组分UDP-GlcNAc。MA-D1和GlmS蛋白直接相互作用并抑制GlmS的酶活,造成UDP-GlcNAc合成受阻及随后的细胞壁瓦解和MRSA死亡。同时MA-D1具有较低的耐药频率,对linezolid, vancomycin和teicoplanin耐药菌均具有很好的杀伤活性,并以GlmS依赖性的方式在MRSA表皮及全身性感染的动物中均具有良好的抗菌活性(图2)。
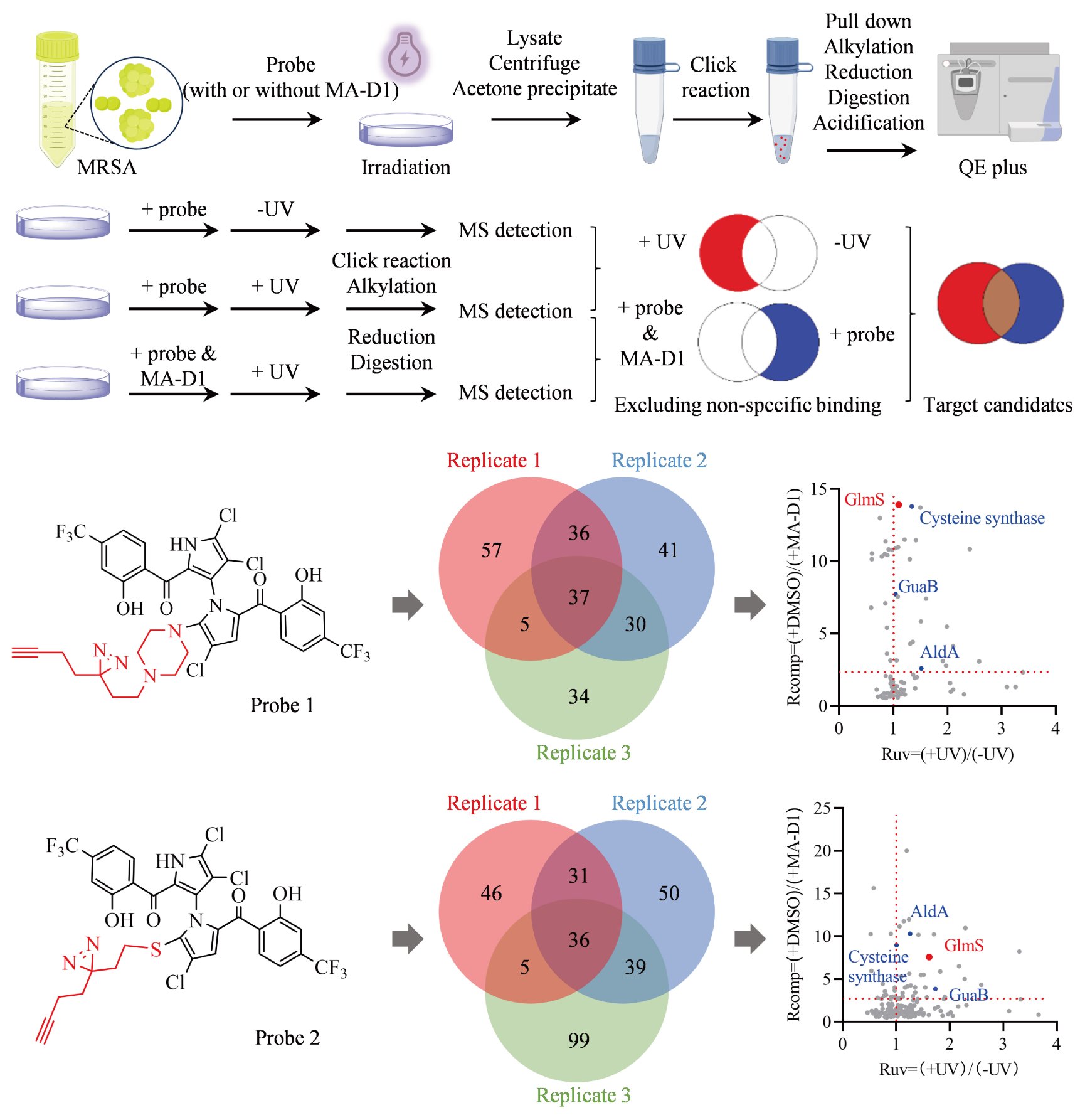
图1. 化学蛋白质组学鉴定MA-D1在MRSA菌内的生物学靶点
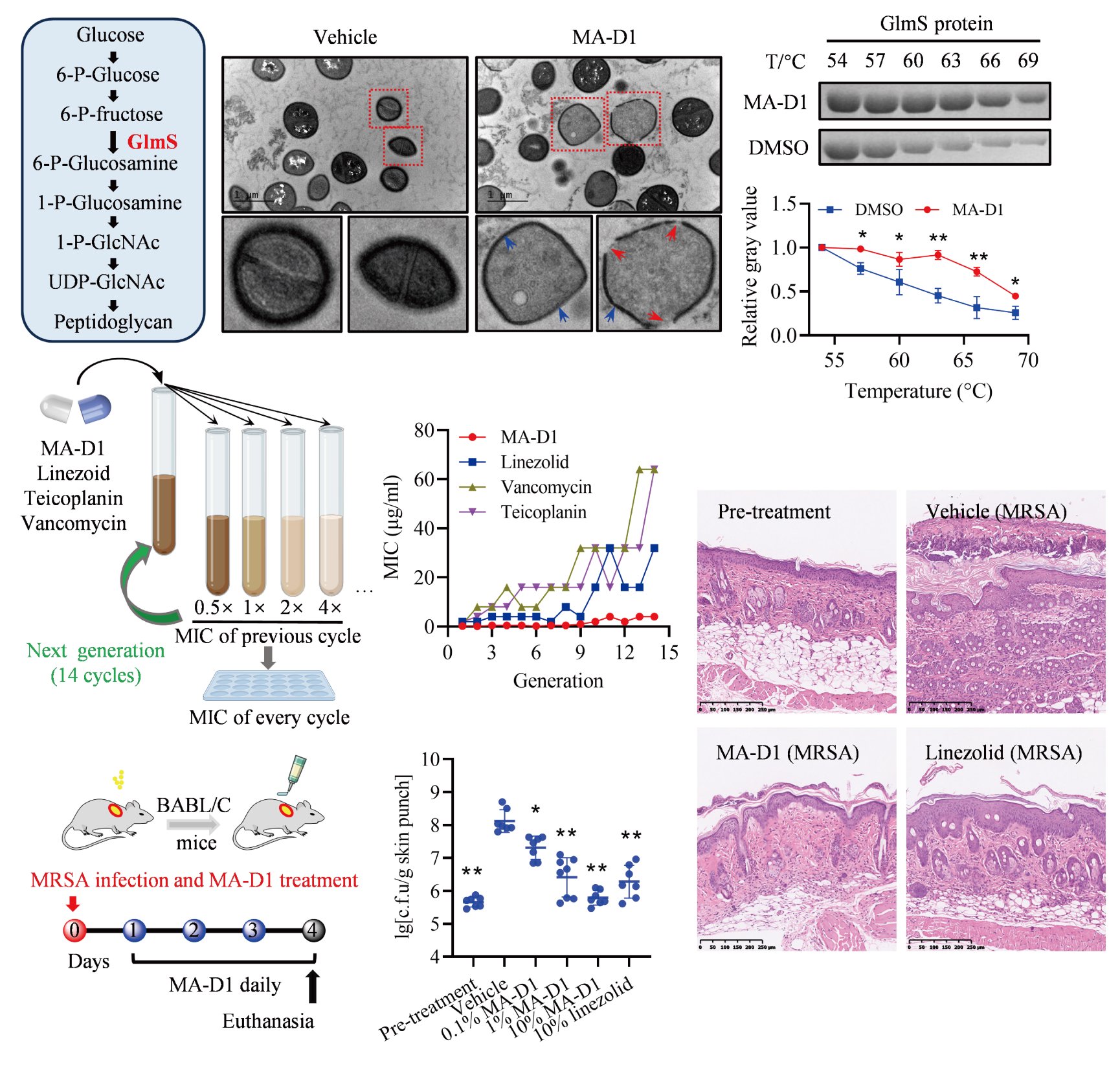
图2. MA-D1通过靶向GlmS在体内外具有良好的抗MRSA活性
目前还没有批准用于临床的GlmS靶向药物,而且也缺乏高成药性的先导化合物,所以靶向GlmS开发新型抗生素是一种完全不同于现有抗生素的全新作用模式,因此基于本工作新建立的GlmS、MA-D1分子及其抗MRSA活性之间的关系,未来有望开发出具有临床使用价值的新型抗生素。
雷晓光教授和秦勇教授为该工作的通讯作者。文章的第一作者为雷晓光团队郭富生博士、肖凡博士和秦勇团队宋颢副教授;秦勇团队的李小勇博士和肖雅心博士也为本工作做出了重要贡献。该工作得到国家重点研发计划、国家自然科学基金、北京分子科学国家研究中心、北大-清华生命联合中心、新基石基金会、中国博士后基金、永利集团博雅博士后等项目和单位的资助。