蛋白质拓扑工程是蛋白质工程的一个新兴领域,通过改变蛋白质的化学拓扑结构,可以显著提升其稳定性、调节动态结构并增强多价效应等功能。然而,传统蛋白质受限于自然转录翻译机制,通常具有线型的主链拓扑结构,这在一定程度上限制了其功能和应用。近年来,科学家们提出,除了线型结构外,蛋白质还可以呈现更为复杂的主链拓扑形式,带来更多的功能优势。
近期,永利集团张文彬课题组在单结构域蛋白质拓扑设计和合成方面取得了重要进展。他们将谍结构域(SpyTag/SpyCatcher)拆分为SpyTag、BDTag和SpyStapler,通过重新编辑三组分之间的连接关系引入缠结关系,设计并合成了索烃蛋白(Catenane)、环状蛋白(Cyclic)、套索蛋白(Lasso)以及准轮烷蛋白(Rotaxane),并通过突变其中一个活性位点,废除原本的异肽键连接,得到了线型蛋白(Linear)、纽结蛋白(Knot)和另一种准轮烷蛋白(Rotaxane(DA))(图1、图2),实现了单结构域蛋白质拓扑亚型的系统构建。
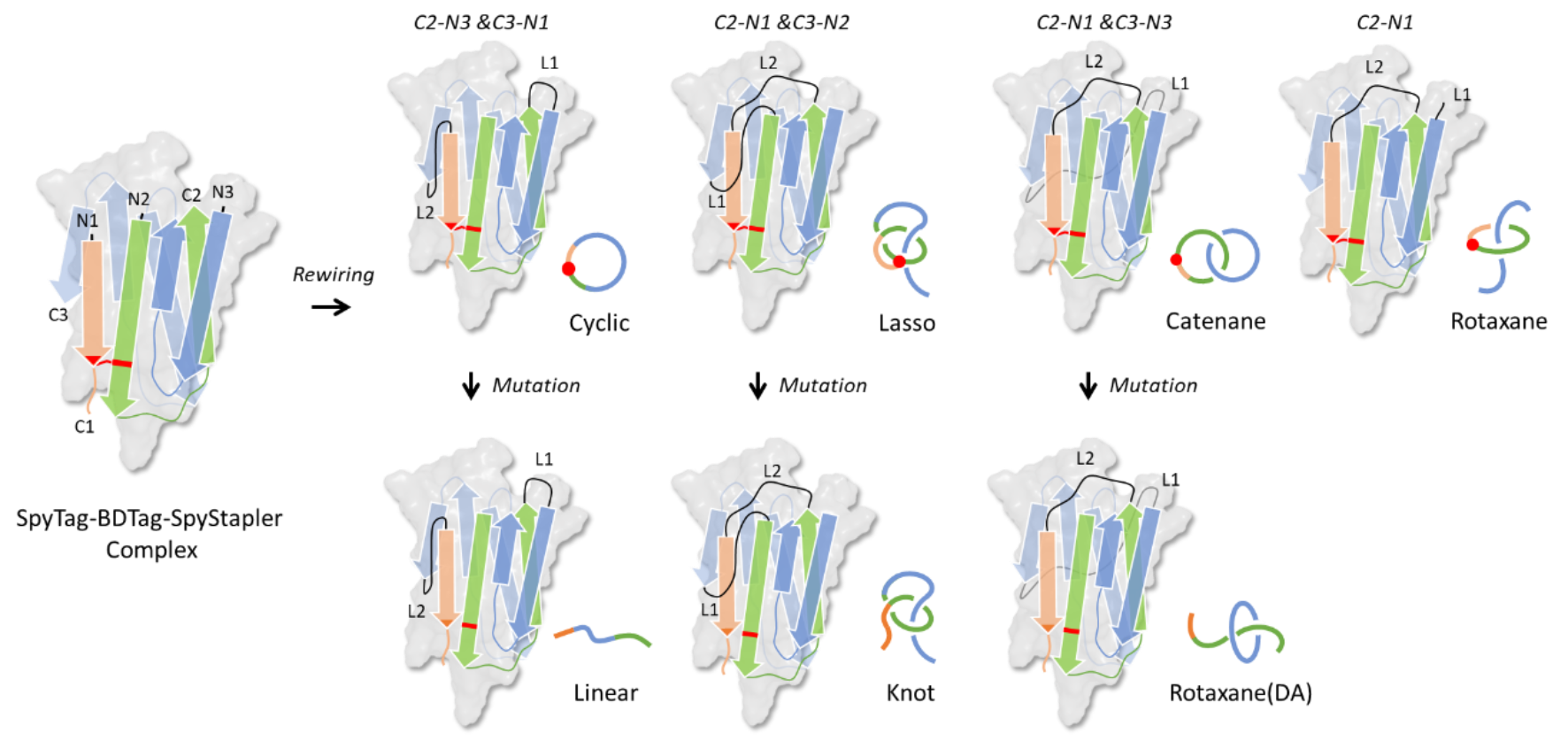
图1. 七种单结构域拓扑亚型(线型、环状、纽结、套索、索烃以及两种准轮烷)的设计。
为优化这一系列拓扑蛋白质的合成,他们设计了两组不同连接链长度的样品进行胞内合成。为最大化拓扑结构对蛋白质构象的限制作用,减少柔性连接链对蛋白质热力学稳定性的影响,他们首先设计了具有最短连接链的一系列对照样品,称为s-series, 其预测结构仍然能有效保持目标的相对空间关系。然而,由于BDTag和SpyTag之间连接链较短,分子内重组无法有效进行,倾向于发生结构域交换,部分样品形成了二聚体(图2A、2B)。为优化反应选择性,他们又设计了一系列长链对照样品(l-series)。实验结果表明,长链样品的主要产物为预期的单结构域蛋白质(图2C)。
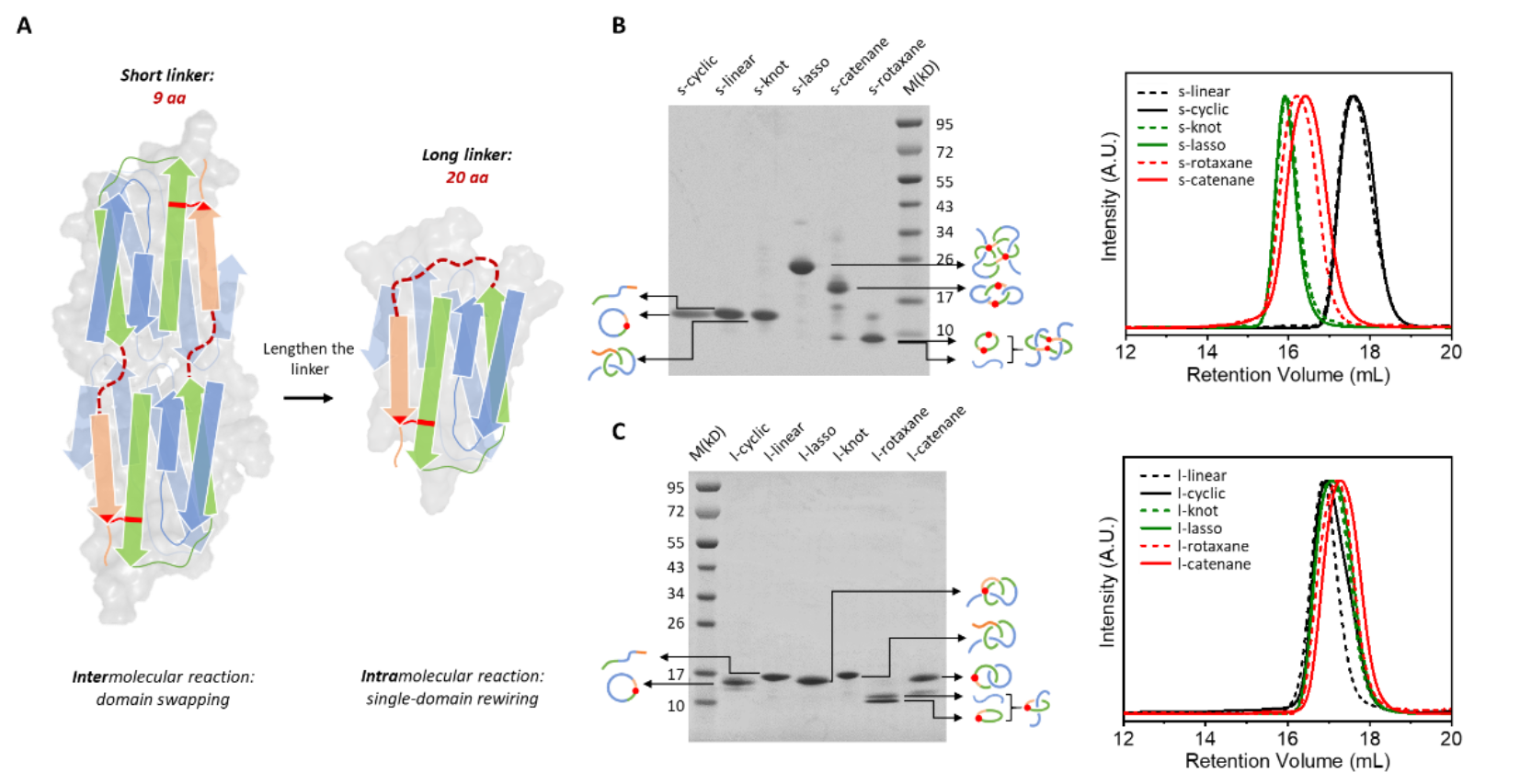
图2.A, 连接链的长度对单结构域拓扑亚型合成选择性的影响。B, 短链接链样品的合成结果。C, 长链接链样品的合成结果。
随后,他们对合成选择性较高的长链样品进行了实验表征。六种样品的圆二色谱分析显示,在230 nm处均观察到β-turn结构的特征峰,表明结构域的拆分未破坏蛋白质的整体二级结构(图3A)。二维核磁共振分析显示,样品表现出与谍结构域类似的交叉峰信号,含异肽键的样品在6 ppm处有特征峰(图3B)。差示扫描量热法测试结果表明,含异肽键的蛋白质比突变体更加稳定,熔点比不含异肽键的突变体高出30°C以上(图3C),表明异肽键在维持蛋白质稳定性方面发挥了重要作用。
为了细致揭示蛋白质拓扑的构效关系,课题组通过实验表征和分子动力学模拟研究了拓扑对蛋白质稳定性和折叠的影响(图3)。研究结果表明,尽管这些蛋白质在常温常压下展现出相似的稳定性和折叠结构,但在高温下,它们的折叠动力学特性却有所不同。在分子动力学模拟中,含异肽键的蛋白质展示出更好的稳定性,而突变体中的氨基酸残基倾向于逐渐互相远离并失去内部接触(图3D)。此外,在高温下,索烃蛋白的两个环呈现出明显的负相关运动,表明它们的运动是相对独立的(图3E)。有趣的是,在解折叠过程中,索烃蛋白还表现出往复的二级结构消失和重形成,这与其宏观上具有更好的热回弹性是一致的(图3F)。
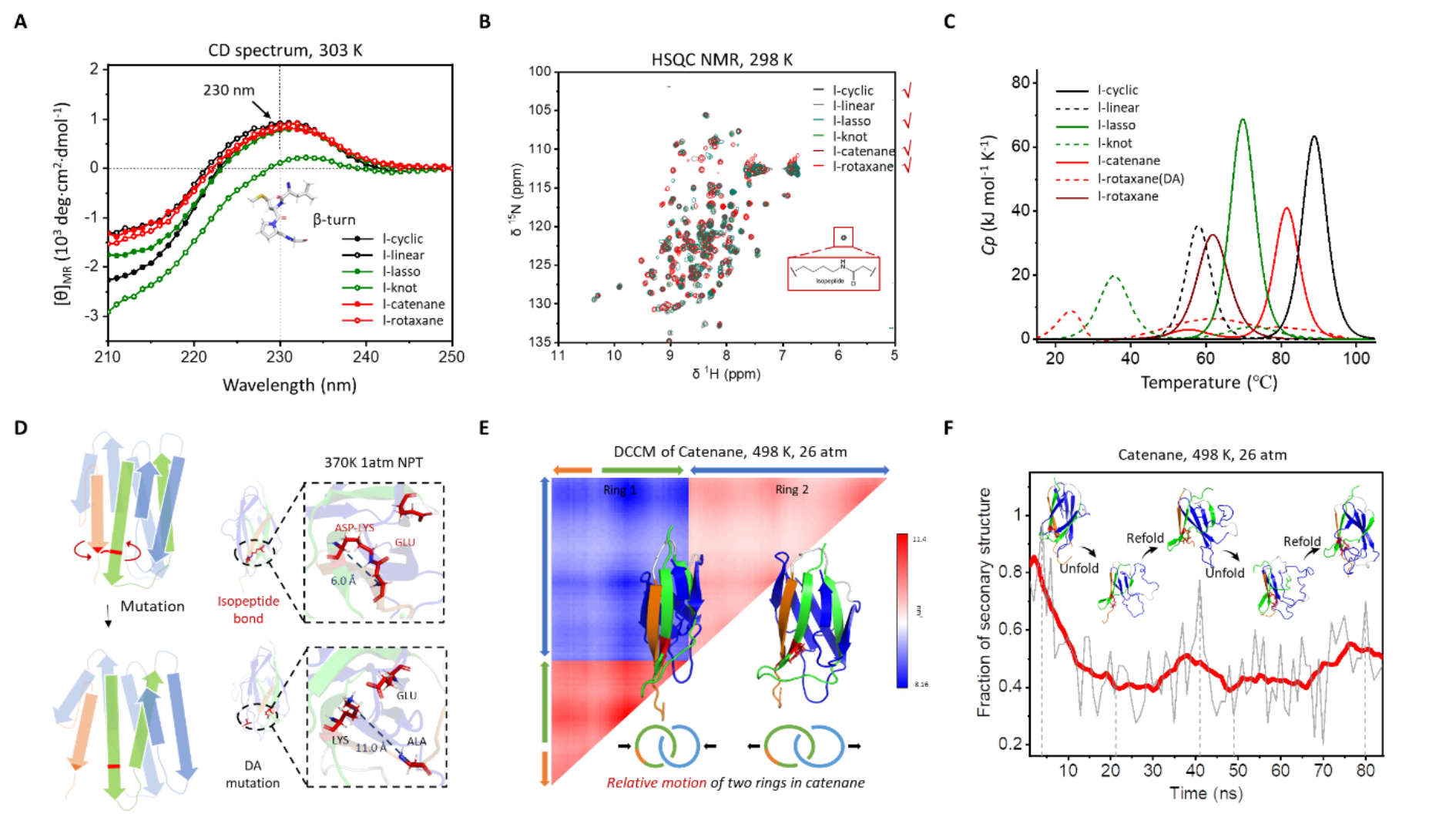
图3.A, 长链样品的圆二色谱表征结果。B,长链样品的二维核磁表征结果。C, 长链样品的差示扫描量热法表征结果。D, 不含异肽键的突变体中氨基酸逐步远离。E, 索烃蛋白的两个环呈现出明显的负相关运动。F, 索烃蛋白的解折叠模拟中还观察到了瞬时的二级结构恢复现象。
综上所述,作者通过谍结构域二级结构基元的重新接线和突点突变,成功设计并合成了七种具有独特拓扑结构的单结构域蛋白质(包括线型、环状、纽结、套索、准轮烷和索烃结构)。实验表征和分子动力学模拟结果表明,这些蛋白质在常温常压下表现出类似的构象,体现出疏水核心的保守性,而异肽键的形成和机械互锁结构则显著影响了蛋白质的稳定性和折叠行为。
该研究近期在线发表于美国国家科学院院刊PNAS,77779193永利集团博士生曲志宇为该论文第一作者。77779193永利集团博士后许连杰,博士生蒋冯逸,研究员刘源也为本工作做出了贡献。77779193永利集团张文彬教授为通讯作者。该工作得到国家自然科学基金委、国家重点研发计划、北京分子科学国家研究中心的大力支持。
原文链接:https://www.pnas.org/doi/10.1073/pnas.2407355121