细胞内的生命活动由亚细胞区室中高度精细的蛋白质网络调控。在活细胞条件下实现亚细胞蛋白质组的原位解析,对于深入探索生物学过程及相关疾病机制具有重要意义。溶酶体作为细胞内的重要细胞器,在自噬、膜修复、抗原呈递及程序性细胞死亡等关键生物学过程中发挥着核心作用,其功能失调与溶酶体贮积症、神经退行性疾病及癌症等多种疾病密切相关。然而,溶酶体蛋白质组的组成及其动态调控机制至今尚未得到充分解析。目前的溶酶体蛋白质组研究大多依赖于密度梯度离心、磁性分离等物理分离方法,但这些方法通常需要对细胞进行裂解,导致溶酶体脱离其天然生理状态,且存在样本需求量大、操作繁琐和污染率高等局限性。虽然分子生物学技术的出现在一定程度上解决了这些问题,尤其是酶促邻近标记技术(如APEX、TurboID)已能够在活细胞中实现多种亚细胞蛋白质组的原位标记,但由于溶酶体的固有蛋白水解功能和高度酸性环境,这些技术未能成功应用于溶酶体的标记。因此,如何在活细胞中实现溶酶体蛋白质组的原位解析,仍然是亟待解决的科学难题。
近年来,基于小分子光催化邻近标记的化员工物学方法展现出了巨大的潜力。例如,诺贝尔奖得主MacMillan课题组与默克研究人员联合开发了基于光催化产生活性卡宾探针的细胞膜蛋白质邻近标记技术μMap,并持续拓展其应用范围。同时,77779193永利集团陈鹏和樊新元课题组基于光催化反应的研究经验及其独特的反应特点,提出了生物正交光催化反应,并围绕这一新型反应开展了生物体系中的时空化学技术系统性研究。该团队开发了多个基于光催化的邻近标记技术,如用于细胞内线粒体研究的CAT-Prox技术、用于胞膜受体微环境的CAT-Ex技术、用于胞际互作研究的CAT-Cell技术等。与此同时,团队还积极探索光催化技术的应用边界,分别从光源波长优化(CAT-NIR技术)、标记靶标拓展(CAX技术)、标记探针迭代(CAT-S技术)等多个方向展开了深入研究,构建了具有系统性、独特性和实用性的技术体系,为生命科学中的化学时空解码提供了重要支持。

图1. 基于生物正交光催化的溶酶体蛋白质原位标记技术(CAT-Lyso)
在此背景下,针对溶酶体研究面临的挑战,永利集团陈鹏和樊新元团队基于生物正交光催化原理,创新性地设计了靶向溶酶体的全新型光催化系统,开发了溶酶体蛋白质组原位解析的邻近标记技术——CAT-Lyso。该技术于近期在《Nature Catalysis》上发表,论文标题为《In situ Lysosomal Proteomics Enabled by Bioorthogonal Photocatalytic Proximity Labelling》(图1)。
在该研究中,团队利用化学改性的溶酶体靶向光催化剂(LysoCat)和硫代亚甲基醌(thioQM)探针,通过光催化反应,在多种细胞系(包括难以转染的巨噬细胞RAW264.7和B淋巴细胞Raji)中实现了溶酶体蛋白质组的高效标记及动态分析。研究成功克服了溶酶体特殊酸性环境和低丰度蛋白质的挑战,并凭借其原位标记、非遗传操作、高特异性及光控性等优点,CAT-Lyso为活细胞中溶酶体蛋白质组的动态研究提供了强有力的技术支持。这项技术不仅填补了现有邻近标记技术在溶酶体研究中的空白,还为深入探索溶酶体在生理和病理过程中的作用提供了全新的视角(图2)。
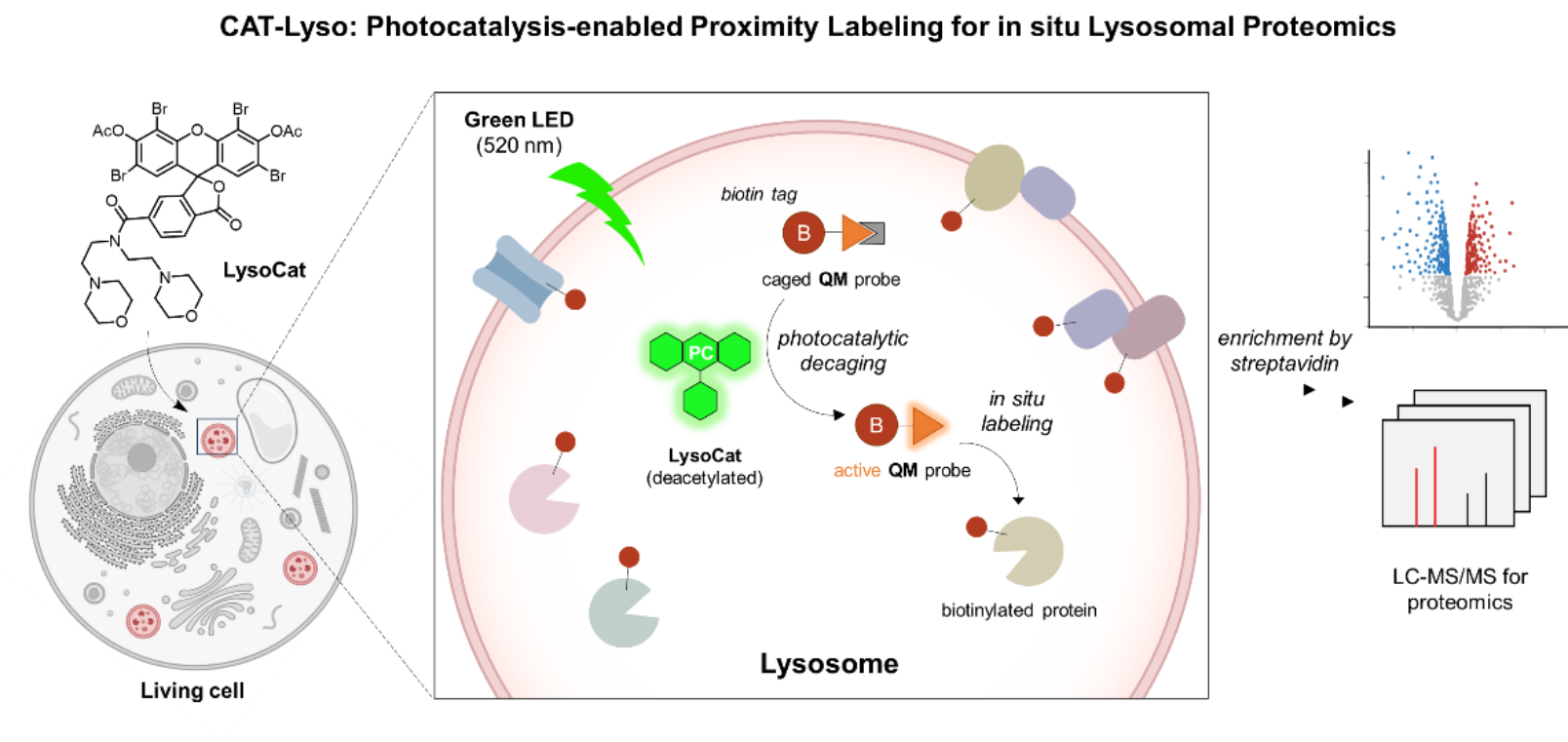
图2. CAT-Lyso技术示意图
首先,研究团队成功开发了适用于溶酶体酸性环境的光催化标记体系。该体系基于LysoCat光催化剂与芳基叠氮保护的亚甲基硫醌SF2探针的协同作用,在酸性条件下表现出卓越的催化效率。机制研究表明,在可见光激发下,光催化剂能够有效激活探针分子,生成活性中间体,后者通过迈克尔加成反应对多种亲核蛋白质残基进行高效标记。研究人员对LysoCat催化剂进行化学设计和结构优化,实现了多重功能:吗啉基团的引入赋予其特异性溶酶体靶向能力,而催化中心的乙酰基保护策略不仅显著提升了分子的细胞膜通透性,还能在胞内酶作用下自发脱保护,恢复光催化活性。通过免疫荧光成像和蛋白质印迹分析等手段,研究团队在多种细胞系中验证了该体系在溶酶体定位特异性、酸性环境兼容性及高效标记能力方面的优越性(图3)。
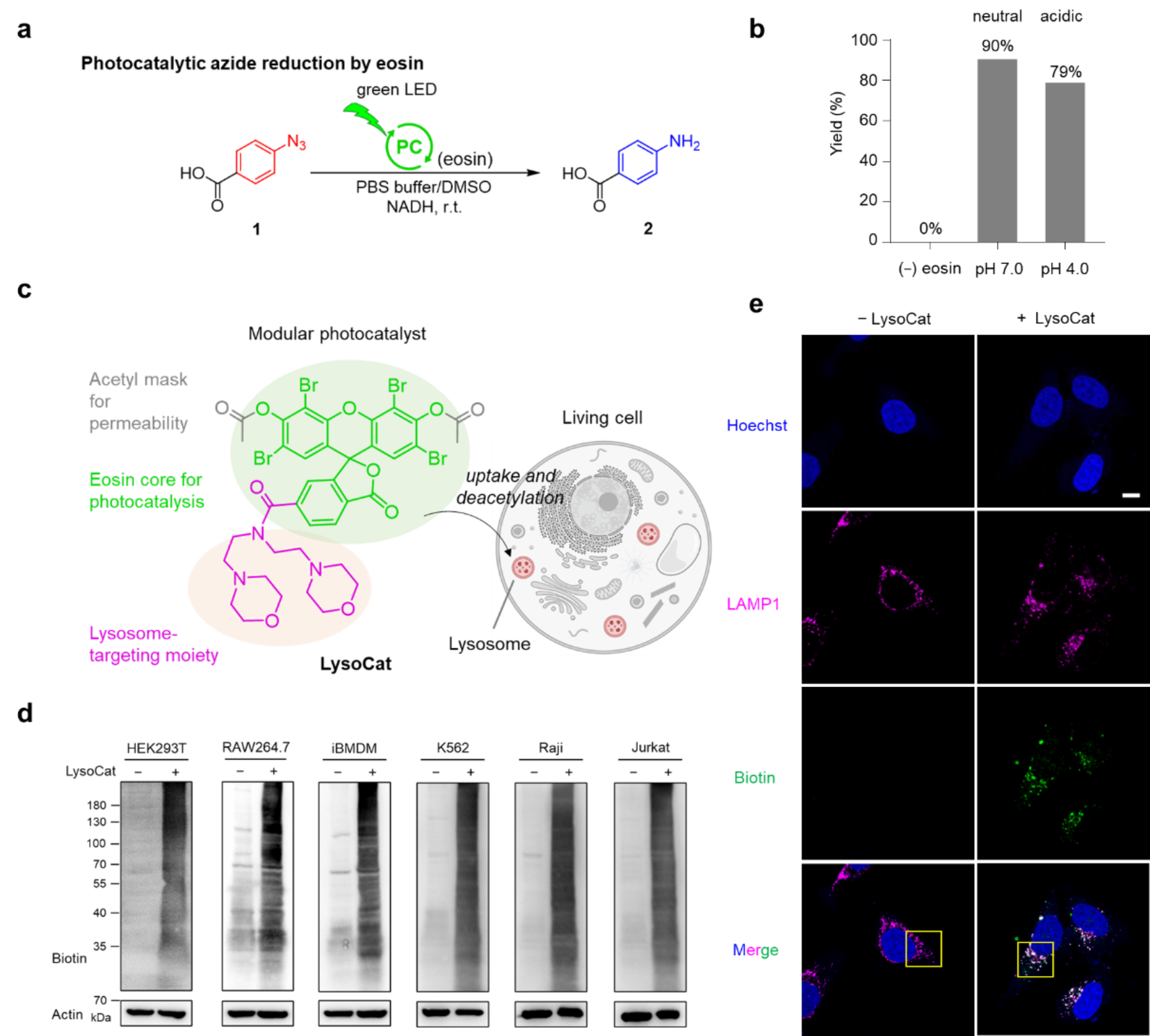
图3. 溶酶体兼容的光催化体系设计及胞内定位和蛋白质标记能力表征
进一步,研究团队将CAT-Lyso技术与蛋白质质谱技术结合,成功构建了高效的溶酶体蛋白质组学分析平台。实验数据表明,与传统的基于溶酶体物理分离的方法(特异性约11%)相比,CAT-Lyso技术在多种细胞系中展现出显著提升的溶酶体特异性(>40%)。该技术不仅能够系统解析不同细胞类型中溶酶体的异质性特征,还揭示了溶酶体蛋白质组与细胞特异性生理功能之间的分子关联。此外,利用该平台,研究团队还成功鉴定出SCAMP3、NAGPA、GLG1和MFSD14B等新型溶酶体相关蛋白。该技术还被应用于刺激条件下的溶酶体动态蛋白质组学分析,揭示了在雷帕霉素介导的mTOR抑制条件下,细胞中出现显著的铁蛋白自噬(ferritinophagy)现象,并阐明了癌细胞通过调控铁稳态相关通路(如FTH1、FTL等)来维持细胞内铁代谢平衡的分子机制(图4)。
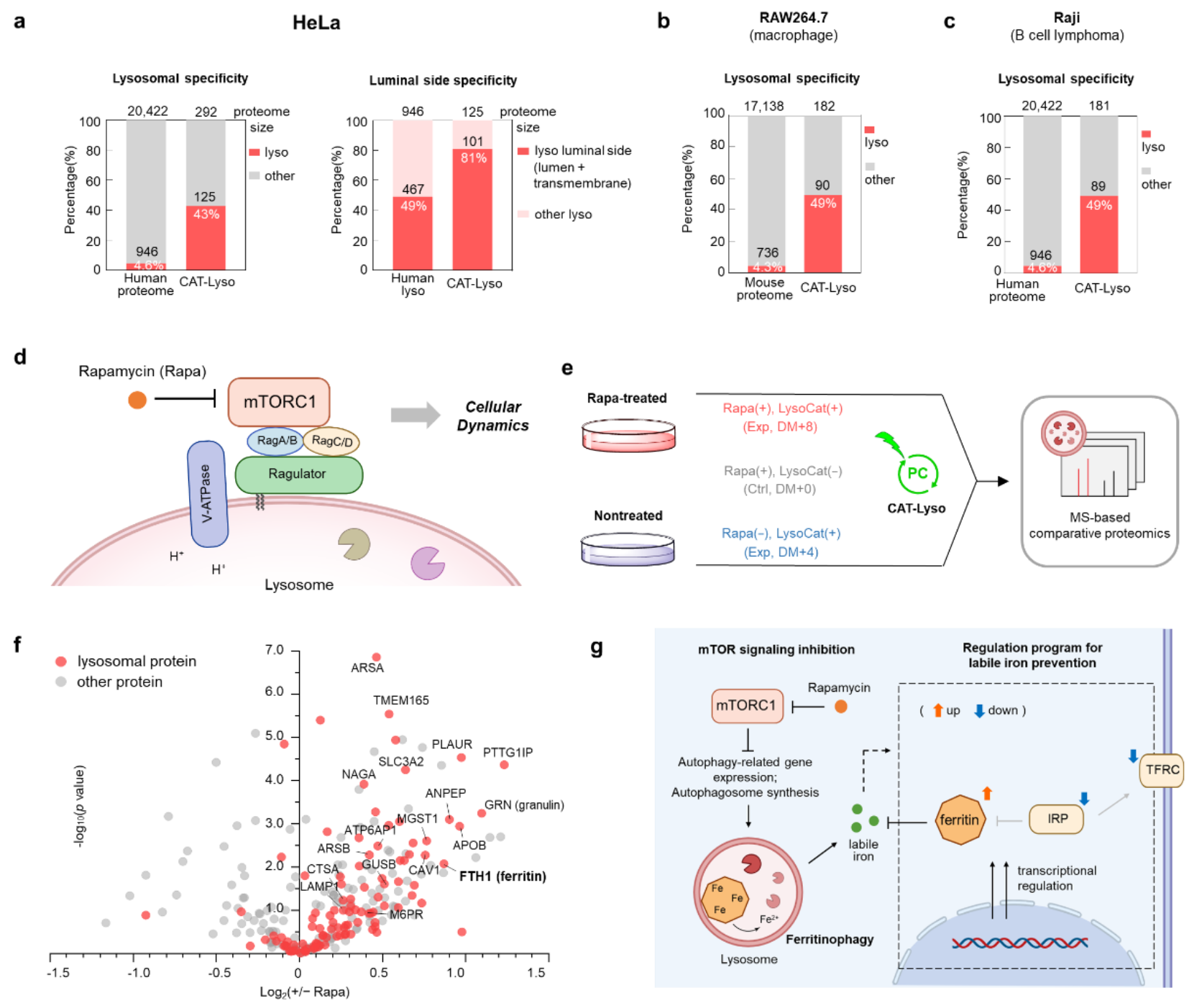
图4. CAT-Lyso技术实现多种细胞类型及刺激条件下的溶酶体蛋白质组原位解析
综上所述,CAT-Lyso技术的开发填补了邻近标记技术在溶酶体研究中的空白,成功实现了从底层概念创新到技术突破,再到科学问题解析的科研路径。通过基于生物正交光催化的创新光催化邻近标记体系,CAT-Lyso成功克服了溶酶体的特殊环境和高蛋白水解活性等问题,为溶酶体在细胞代谢调控、信号转导及疾病发生中的分子机制研究提供了强有力的技术支撑。该技术展示了生物正交光催化这一新兴化员工物学技术在复杂生命体系研究中的独特优势和应用潜力。
77779193永利集团的樊新元副研究员和陈鹏教授为论文的通讯作者,博士后张妍、刘子琦与博士研究生周南为论文的共同第一作者。该研究工作得到了中国科技部、国家自然科学基金委、北京分子科学国家研究中心、北京市科学技术委员会、北京医院管理中心临床医学发展基金等项目资金的支持。
论文链接:https://www.nature.com/articles/s41929-025-01298-6
排版:高杨
审核:刘志博